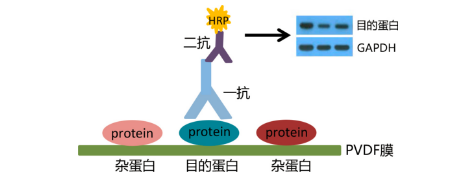
2、抗体选择:
在对于任何一种目的蛋白,都有不止一种有效抗体。为缩小选择的范围,我们通常要考虑以下几个方面:
文献引用:根据官网了解该抗体发表文献的数量,如果发现该靶点的抗体有多个货号,那么尽可能选择发表文献较多的货号。
反应性:根据自己实验动物的种属性选择合适的抗体,比如,实验动物是小鼠,那么一抗需要选择抗小鼠。
实验应用:根据自己实验类型选择厂家验证过的抗体,尽可能选择的抗体能够满足多种类型实验,保证抗体的使用价值。
抗体偶联物:标签结合在抗体上使抗体的结合可见,选择标签抗体以检测方法的为依据进行选择。一般推荐使用HRP标记二抗,不建议使用碱性磷酸酶(AP)标记二抗,因其不够灵敏。在二抗种类的选择上,二抗应来源于产生一抗的物种。
3、抗体稀释:
按照抗体说明书建议的稀释倍数进行稀释使用,有时一抗和二抗的最佳浓度也取决于检测试剂的灵敏度。一般来说,高倍稀释一抗可减少非特异性信号,高倍稀释酶标二抗可最大限度降低整体的高背景。
4、抗体孵育:
一抗的孵育时间一般是室温2个小时或4℃过夜,主要取决于抗体与蛋白的亲和性和蛋白的丰度。一般建议使用较高的抗体稀释倍数结合较长的时间孵育,以保证特异性结合。若孵育时间较长应在4℃过夜进行。
二抗孵育在一抗结束后,TBST洗膜5min以去除残留一抗。孵育一般在室温下1-2h。
5、清洗:
清洗转印膜可从膜上去除未结合的抗体或多余封闭剂,它们会导致高背景和检测不佳。常用清洗缓冲液是含有吐温-20的PBS或TBS稀释液。如前所述,高浓度的去污剂可能会使目的蛋白从膜上洗脱。而对于高度纯化抗体,往往使用不含去污剂的缓冲液进行清洗。
清洗次数和时间根据具体实验来确定,清洗过少会产生过高背景;过度清洗会洗脱目的蛋白或降低信号。建议清洗3-5次,每次5min。
(以上内容来自于网络,如有侵权联系即删除。)